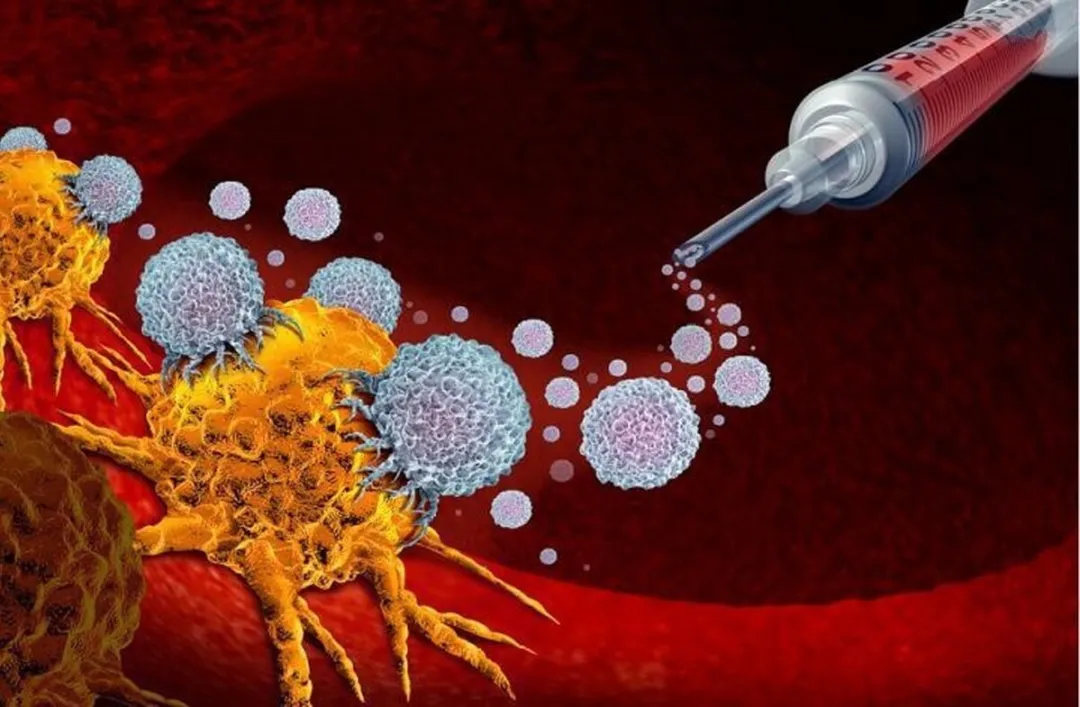
برخی از بیماران در ابتدا به خوبی به درمان پاسخ می دهند، اما مقاومت می تواند ایجاد شود و باعث ظهور مجدد سرطان شود. مهارکننده های ایست بازرسی یکی از ابزارهای متعدد برای مبارزه با سرطان هستند. برای این درمان، بیماران تزریق داخل وریدی پر از آنتی بادی دریافت می کنند.
به گزارش پایگاه خبری علم و فناوری : مریم اسلامی؛ پزشک و دکتری تخصصی ژنتیک،فلوشیپ پزشکی بازساختی:راه های زیادی برای بالا رفتن از کوه وجود دارد. این جمله به ویژه در تحقیقات سرطان، جایی که دانشمندان در حال بررسی چندین راه برای مبارزه با تومورها هستند، صادق است.
یک استراتژی امیدوارکننده شامل مهارکنندههای ایست بازرسی، داروهای ضد سرطانی است که نتایج دلگرمکننده و در عین حال گاهی متناقض برای مبتلایان به سرطانهای پیشرفته ارائه میکند. برخی از بیماران در ابتدا به خوبی به درمان پاسخ می دهند، اما مقاومت می تواند ایجاد شود و باعث ظهور مجدد سرطان شود. تلاشهایی برای اصلاح این درمانها وجود دارد ، برای اطمینان از اثربخشی طولانیتر و عوارض جانبی کمتر.
به عنوان بخشی از مجموعه ای از درمان های سرطان، این مقاله به یک رویکرد جدید می پردازد: مهارکننده هایی که به پروتئینی به نام PD-L۲ حمله می کنند. همانطور که تصویر نشان می دهد، این پروتئین با PD-۱، یک هدف ضد سرطانی تایید شده، تعامل دارد. اگرچه در حال حاضر این مکانیسم آزمایشی است، اما میتواند مکمل بازدارندههای موجود PD-۱ و PD-L۱ باشد و نتایج بیمار را بهبود بخشد.
بازدارنده های ایست بازرسی چگونه کار می کنند
مهارکننده های ایست بازرسی یکی از ابزارهای متعدد برای مبارزه با سرطان هستند. برای این درمان، بیماران تزریق داخل وریدی پر از آنتی بادی دریافت می کنند. آنتی بادیها وارد جریان خون میشوند و مولکولهای خاصی را که در سلولهای ایمنی به نام پروتئینهای نقطه چک یافت میشوند، هدف قرار میدهند. این درمان با مسدود کردن پروتئین های ایست بازرسی، توانایی ذاتی سیستم ایمنی را برای مبارزه با سرطان را آزاد می کند.
اگرچه این درمان پروتئین های ایست بازرسی را مسدود می کند، اما این بدان معنا نیست که ایست های بازرسی ایمنی ذاتاً آسیب رسان هستند. در واقع، سیستم ایمنی به طور معمول به این پروتئین ها برای کاهش سرعت سلول های ایمنی بیش فعال، متکی است. این از آسیب رساندن سلول های ایمنی به بافت های سالم جلوگیری می کند، همانطور که در بیماری های خودایمنی دیده می شود.
مسئله مربوط به سلول های سرطانی است. تومورها می توانند پروتئین های مختلفی را در سطح سلول خود بیان کنند تا به رشد بیرویهی آنها کمک کند.
این بیان پروتئین در سلول های طبیعی متفاوت است و حتی از سلول سرطانی به سلول سرطانی دیگر متفاوت است. برخی از سلولهای سرطانی از پروتئینهای ایست بازرسی برای خاموش کردن سلولهای ایمنی استفاده میکنند.
مهارکننده های ایست بازرسی، این سلول های ایمنی مبارزه کننده با سرطان را آزاد می کنند. آنها قبل از سلول های سرطانی و سایر سلول ها به پروتئین های ایست بازرسی متصل می شوند و سلول ایمنی را آزاد می کنند تا فعال شوند.
یک رقیب جدید با نام ایست بازرسی PD-L۲
در طول سالها، محققان پروتئینهای بسیاری از نقاط بازرسی را کشف کردهاند. تا به امروز، تمام مهارکننده های مورد تایید ایالات متحده یکی از سه پروتئین نقطه بازرسی را هدف قرار می دهند: CTLA-۴، PD-۱ یا PD-L۱
پروتئین مرگ سلولی برنامه ریزی شده ۱ یا PD-۱ یک نقطه بازرسی است که عمدتا در سلول های T یافت می شود. هنگامی که به یک مولکول شریک در سلول های دیگر به نام PD-L۱ یا لیگاند مرگ سلولی برنامه ریزی شده ۱ متصل می شود، سلول T را از مقابله به مثل در برابر تومورها منع می کند.
مسدود کردن هر یک از پروتئین ها می تواند یک پاسخ ضد توموری قوی ایجاد کند
با این حال، PD-۱ یک شریک کمتر شناخته شده دیگر دارد ، پروتئینی به نام PD-L۲ یا لیگاند مرگ برنامه ریزی شده ۲. مستقل از PD-L۱، این پروتئین محکم به نقاط بازرسی PD-۱ متصل می شود تا پاسخ های سلول های T قاتل را آرام کند. همچنین می تواند در مهاجرت و پیشرفت تومور نقش داشته باشد. با این حال، بیان PD-L۲ معمولاً محدودتر از همتای خود است.
PD-L۲ به عنوان یک هدف بالقوه ضد تومور توجه را به خود جلب کرده است. این پروتئین در انواع مختلف سرطان بیان می شود، گاهی بیشتر از PD-L۱، گاهی اوقات در غیاب PD-L۱ . به عنوان مثال می توان به کارسینوم سلول کلیه، کارسینوم سلول سنگفرشی سر و گردن و سرطان دهانه رحم اشاره کرد. با مهار PD-L۲، ممکن است بتوان پاسخ های ایمنی ضد توموری را تقویت کرد، به ویژه در سرطان هایی که بیان PD-L۲ ، برجسته است.
توسعه پتانسیل درمانی
در حالی که قبلا نادیده گرفته شده بود، فعل و انفعالات PD-L۲ نقش مهمی در سیستم ایمنی ایفا می کند و باید به عنوان یک هدف درمانی در کنار سایر نقاط بازرسی ایمنی در نظر گرفته شود. هدف قرار دادن این پروتئین ممکن است برای بهینه سازی مهارکننده های ایست بازرسی فعلی، که در سرکوب تومورهای خاص تلاش می کنند، ضروری باشد. در حالت ایدهآل، درمانهای موجود را میتوان تغییر داد یا با داروهای دیگر ترکیب کرد تا وسعت درمانی آنها را افزایش دهد و هدفگیری PD-L۲ بیشتری را در بر گیرد.
پس چگونه می توان هدف گذاری PD-L۲ را بهبود بخشید؟ این سوال بی پاسخ چندین راه حل بالقوه دارد
یک راه حل، بهبود اتصال مهارکننده PD-۱ است. یک مطالعه پیش بالینی تومورهای تخمدان از یک مهار کننده محلول PD-۱ استفاده می کند که قوی تر از مهار کننده های استاندارد PD-۱ به مولکول های شریک خود متصل می شود. مهارکننده محلول با موفقیت هر دو تعامل PD-L۱ و PD-L۲ را مسدود میکند و تومورهای تخمدان را کاهش میدهد که درمان آن با مهارکنندههای ایست بازرسی بسیار دشوار است.
گزینه دیگر ایجاد مهارکننده های مستقل ضد PD-L۲ است. آنها را می توان در کنار سایر مهارکننده های ایست بازرسی برای حمله به چندین مسیر ایمنی یا مکمل سایر درمان های سرطان مانند شیمی درمانی تجویز کرد.
یک مطالعه نشان می دهد که چگونه چنین بازدارنده ای می تواند با اثر منفی شیمی درمانی به نام پیری مبارزه کند. پیری یک پدیده طبیعی است که از تکثیر سلول های آسیب دیده یا سرطانی جلوگیری می کند. با این حال، شیمی درمانی و سایر درمان های سرطان می توانند نوعی پیری را القا کنند که در واقع رشد تومور را تشویق می کند. این سلول های سرطانی و پیر در برابر تشخیص ایمنی با استفاده از ایست های بازرسی PD-L۲ مقاومت می کنند.
مهارکنندههای PD-L۲ میتوانند این نقاط بازرسی را مسدود کنند و سلولها را مستعد درمان کنند. در واقع، آزمایش پیش بالینی نشان می دهد که در حالی که مهارکننده PD-L۲ آنها به تنهایی رشد تومور را سرکوب نمی کند، همراه با شیمی درمانی، می تواند تومورها را با حداقل عوارض جانبی از بین ببرد.
هدف گیری PD-L۲ همچنین می تواند در واکسن های سرطان جدید ادغام شود. این واکسن ها حاوی سلول های ایمنی مانند سلول های دندریتیک یا ماکروفاژها با ژن های خاموش شده PD-L۱ و PD-L۲ هستند. از آنجایی که این سلولها فاقد پروتئینهای ایست بازرسی هستند، واکسن باید سیستم ایمنی را تحریک کند تا تومورها را شناسایی کند و به آنها حمله کند.
در نهایت، داروهایی با مولکولهای کوچک را میتوان مهندسی کرد تا مستقیماً پروتئین را مسدود کنند، زیرا یک کارآزمایی بالینی تومورهای جامد و لنفومهای مختلف را بررسی میکند. از طرف دیگر، داروها می توانند فاکتورهای رونویسی و سایر پروتئین هایی را که به طور غیرمستقیم بر بیان PD-L۲ روی سلول ها تأثیر می گذارند، هدف قرار دهند. هر دو گزینه می توانند در کنار بازدارنده های ایست بازرسی موجود، برای تقویت اثر آنها استفاده شوند.
PD-L۲ و میکروبیوم کشف شد که این پروتئین میتواند با مولکول دیگری فراتر از PD-۱-یک پروتئین متصل به غشاء به نام RMGb یا مولکول هدایت دفعی b- تعامل کند. تعامل بین این دو مولکول پاسخ های ایمنی در ریه ها و میکروبیوم روده را تنظیم می کند. شواهد نوظهور و دلگرم کننده حاکی از آن است که مسدود کردن این مسیر ایمنی ممکن است به طور اساسی پاسخ های ضد توموری وابسته به میکروبیوم را در زمانی که تومورها در برابر مهارکننده های PD-۱ و PD-L۱ مقاومت می کنند، تقویت کند. این استراتژی امیدوارکننده در آینده بیشتر مورد بررسی قرار خواهد گرفت.
تومورها دشمنانی هستند که سیستم ایمنی را دستکاری میکنند و در برابر بسیاری از فناوری های پیشرفته از جمله مهارکننده های ایست بازرسی مقاومت می کنند. بهبود هدف گیری PD-L۲ در داروهای ضد سرطان می تواند به ما مزیت لازم برای سرکوب سلول های سرطانی را برای مدت طولانی تری بدهد. تحقیقات بیشتر در مورد مکانیسم های تنظیمی این پروتئین و اثرات هم افزایی آن با سایر درمان های سرطان نشان می دهد که بقای درمانی آن همچنان ادامه خواهد داشت.
-
برچسب ها :
- ایمونوتراپی -
- سرطان -
1403/03/22 12:22
1403/03/21 17:29
1403/03/21 14:06
1403/03/21 14:03
1403/03/21 13:04
1403/03/21 13:02
1403/03/21 12:48